CEA(CEACAM5)抗體結合表位研究
癌胚抗原相關細胞粘附分子(CEACAM)包括CEACAM1、CEACAM3至CEACAM8、CEACAM16以及CEACAM18至CEACAM21,屬于膜相關細胞表面的糖蛋白家族,它們在細胞粘附、信號傳遞及腫瘤轉移過程中扮演著重要角色。這類分子在肺部、結直腸及胃部組織的某些腫瘤細胞中呈現出表達上調的現象,使其成為抗體-藥物偶聯物的一個極具潛力的靶標。CEACAM的胞外結構域(ECD)由重復的免疫球蛋白(Ig)樣結構域組合而成,包含一個位于N端的免疫球蛋白可變(IgV)樣結構域,以及數量可多達六個的免疫球蛋白恒定C2(IgC2)樣結構域(分為A型和B型)。這些結構域在不同類型的CEACAM之間展現出了高度的序列一致性和結構相似性。此外,CEACAM的ECD還包含多達28個潛在的N-糖基化位點。糖基化的差異性對蛋白-蛋白相互作用及疾病發展進程具有顯著影響。因此,為防止臨床診斷時出現假陽性結果,或在免疫治療中引發脫靶效應或靶外腫瘤毒性,CEACAM靶向抗體必須具備高度的特異性,以避免與其他類型的CEACAM發生交叉反應。
1.CEACAM5特異性抗體
Tusamitamab ravtansine(SAR408701)是一種針對CEACAM5(即CEA)的抗體-藥物偶聯物,用于治療晚期非鱗狀非小細胞肺癌(NSCLC)和其他實體腫瘤。其抗體成分tusamitamab靶向CEACAM5的A3-B3結構域,不與CEACAM1、CEACAM6或CEACAM8結合,這意味著A3-B3結構域表面存在獨特的結合區域,賦予抗體特異性。
2.抗體抗原結合界面分析
為了了解tusamitamab與CEACAM5A3-B3的結合機制和特異性,研究人員采用了多種方法對結合界面進行了殘基鑒定和結構分析。
2.1研究方法
1)利用低溫電子顯微鏡(cryo-EM)描述CEACAM5 A3-B3結構域與tusamitamab抗原結合片段(tusa Fab)復合物的高分辨率結構。
2)通過表面等離子體共振(SPR)分析丙氨酸突變對CEACAM5與tusa Fab結合的影響,進一步表征結合界面。
3)通過氫-氘交換耦合質譜(HDX-MS)比較CEACAM5與tusa Fab結合前后氫-氘交換的差異,鑒定表位殘基。
2.2研究結果
2.2.1cryo-EM結構分析
1)糖基化
tusa Fab和hCEACAM5A3-B3的結構完全由β鏈和β片組成(圖1b)。hCEACAM5的A3和B3結構域具有典型的IgC2結構域β-三明治結構。研究人員在hCEACAM5A3-B3區域鑒定了7個聚糖,包括Asn612殘基上的N-連接甘露糖,該甘露糖與tusa Fab重鏈Gly54和Gly56殘基形成氫鍵(圖1c)。
2)結合界面
hCEACAM5-tusa Fab結構揭示了tusa Fab的重、輕鏈與hCEACAM5A3-B3(主要在B3區)的結合。
A.重鏈結合界面
hCEACAM5-tusa Fab重鏈結合界面的掩埋表面積覆蓋455?2,涉及hCEACAM5 B3結構域的12個殘基(Pro621至Ser626、Gln635至Val639和Phe641)和14個tusa Fab重鏈殘基(Val28、Ser30至Asp33、Ser53和His99至Pro106)。
在這個界面中檢測到一個由8個氫鍵組成的網絡,有的氨基酸會形成多個氫鍵。特別是,tusa Fab重鏈殘基Ser31與3個hCEACAM5殘基(Gln635、Thr637和Val639);tusa Fab重鏈殘基Ser104與3個hCEACAM5 殘基(Ser622和Gln624);CEACAM5 Ser622與2個tusa Fab重鏈殘基(Ser103和Ser104)。
雖然界面中的一些殘基存在疏水效應,但大多數殘基距離太遠無法相互作用(>5 ?)。只在hCEACAM5 Phe641和tusa Fab重鏈Val28之間發現了1個潛在的疏水作用位點,殘基間距為~4.2 ?。
B.輕鏈結合界面
hCEACAM5-tusa Fab輕鏈界面的掩埋表面積達到344 ?2,涉及12個hCEACAM5氨基酸(A3結構域:Asn509、Lys511、Val513、Asp588和Leu590;B3結構域:Pro621、Ser622、Gln624、His636、Asn659、Leu660、Ala661)和9個tusa Fab輕鏈氨基酸(Glu27、Asn28、Phe30、Ser31、Tyr32、Tyr49、Asn50、His91、Tyr92)。hCEACAM5殘基Leu660、Lys511和Gln624分別與tusa Fab輕鏈殘基Tyr32、Tyr92和Asn50形成氫鍵。
此外,該界面有一個疏水區,涉及4個hCEACAM5殘基(Pro621、Leu590、Leu660和Ala661)和3個tusa Fab輕鏈殘基(Phe30、Tyr32和Tyr92),這些殘基在3.7 ?和4.7 ?距離上具有正ΔGsolv值。
值得注意的是,hCEACAM5 B3結構域中的Gln624與tusa Fab重鏈和輕鏈殘基均形成氫鍵。hCEACAM5A3-B3和tusa Fab之間的結合界面相互作用不涉及鹽橋或二硫鍵(圖2)。
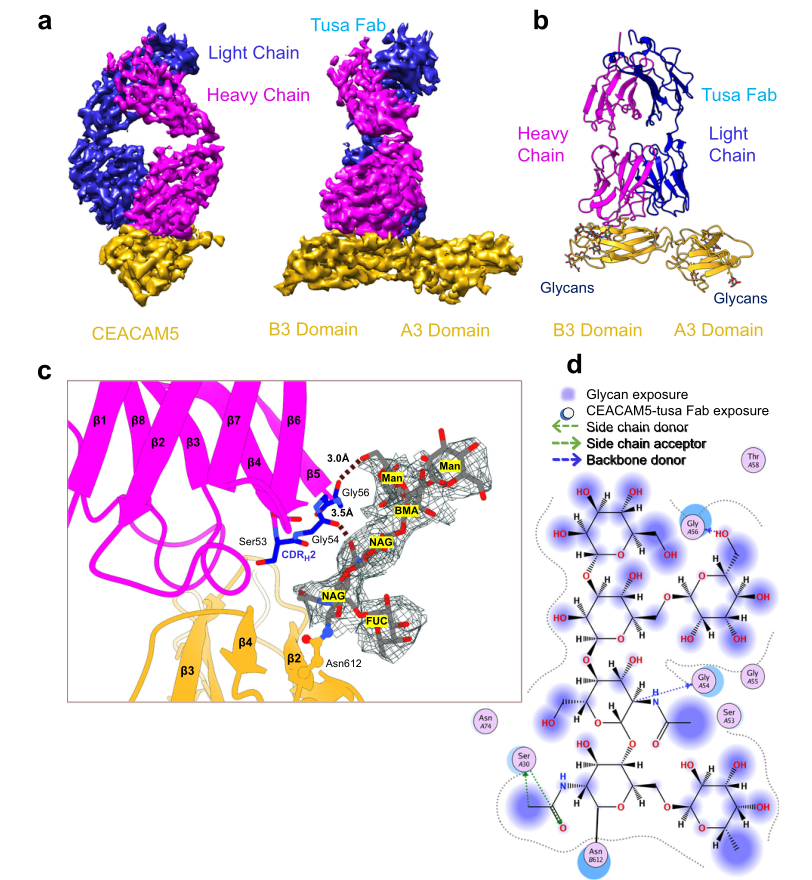
圖1. hCEACAM5A3-B3與tusa Fab復合物的低溫電鏡結構
注:BMA:β-d-甘露糖;CDRH2:互補決定區重鏈2;CEACAM5:癌胚抗原相關細胞粘附分子5;cryo-EM:低溫電鏡;FUC:α-l-果糖;hCEACAM5:人癌胚抗原相關細胞粘附分子5;hCEACAM5A3-B3:人癌胚抗原相關細胞粘附分子5的A3-B3結構域;Man:α-d-甘露糖;NAG:N-乙酰-β-D-氨基葡萄糖;tusa Fab:tusamitama抗原結合片段。
hCEACAM5A3-B3與tusa Fab結合的Cryo-EM圖譜。a.中右圖為左圖在縱軸上旋轉90°視圖。b.為hCEACAM5A3-B3(金帶)與tusa Fab(洋紅和藍帶)結合的帶狀結構示意圖。箭頭表示一個β鏈,圓棒表示N-鏈聚糖。c.hCEACAM5 B3(金帶)結構域Asn612殘基上的N-連接甘露糖與tusa Fab重鏈(洋紅帶)之間相互作用的放大視圖。圖中tusa Fab重鏈CDRH(藍色)Gly54、Gly56與聚糖(深灰色)之間的相互作用用虛線表示。聚糖片段周圍的線網表示模型與低溫電鏡密度圖的擬合結果。d.分子操作環境(MOE)生成的聚糖配體相互作用圖。hCEACAM5的相互作用殘基用圓圈表示,A和B分別表示A3和B3結構域的殘基。

圖2.hCEACAM5A3-B3與tusa Fab相互作用的關鍵表位
注:CDRH:重鏈互補決定區;CDRL:輕鏈互補決定區;hCEACAM5:人癌胚抗原相關細胞粘附分子5;hCEACAM5A3-B3:人癌胚抗原相關細胞粘附分子A3-B3結構域;tusa Fab:tusamitama抗原結合片段。
hCEACAM5的主架和側鏈呈灰色。a.圖中tusa Fab的CDRH1(洋紅色)和CDRH3(黃色)通過與CEACAM5的B3結構域形成氫鍵網絡來促進相互作用;虛線表示氫鍵。CDRH3的殘基主要在CDRH3的Ser104、Ser103和Phe101與hCEACAM5 B3結構域的Ser622、Gln624和His636之間形成強氫鍵相互作用網絡。CDRH1殘基Ser31與hCEACAM5 B3結構域的Gln635、Val639和Thr637形成氫鍵。b.CDRL1(青色),CDRL2(珊瑚色)和CDRL3(綠色)與hCEACAM5A3-B3結構域相互作用。CDRL1的Tyr32、CDRL2的Asn50和CDRL3的Tyr92分別與hCEACAM5A3-B3結構域的Leu660、Gln624和Leu511形成氫鍵。
2.2.2SPR分析
在初始篩選中,重鏈上的5個變體(Asp33Ala、Phe101Ala、Gly102Ala、Gly105Ala和Pro106Ala)和輕鏈上的2個變體(Tyr32Ala和Asn50Ala)完全失去與hCEACAM5ECD的結合能力;重鏈中的4個變體(Tyr32Ala、Tyr50Ala、His99Ala和Tyr100Ala)和輕鏈中的4個變體(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)與hCEACAM5的結合減弱。
此外,重鏈中的7個變體(Tyr32Ala、Asp33Ala、Tyr100Ala、Phe101Ala、Gly102Ala、Gly105Ala和Pro106Ala)和輕鏈中的2個變體(Tyr32Ala和Asn50Ala)完全破壞了hCEACAM5tusa Fab+Fc復合物的穩定性。重鏈中的另外兩個變體(Tyr50Ala和His99Ala)和輕鏈中的4個變體(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)導致復合物穩定性降低。
綜上所述,這些發現表明tusa Fab抗體結合區包含重鏈的第三個互補性決定區(CDR3)(殘基96-108)。來自重鏈CDR1(殘基32和33)、輕鏈CDR1(殘基32)和輕鏈CDR3(殘基91和92)的一些殘基也可能有助于抗體結合區相互作用。
在第二組SPR實驗中,選擇在SPR篩選實驗中%Rmax和%Remaining與野生型(WT)不同的20個tusa Fab+Fc變體,進行進一步評估。值得注意的是,相對于tusa Fab+Fc WT(KD=14.0nM),重鏈中的2個變體(Tyr50Ala和His99Ala)和輕鏈中的4個變體(Phe30Ala、His91Ala、Tyr92Ala和Pro95Ala)與hCEACAM5ECD的結合親和力降低(KD=306.5nM至13.5μM)(表1)。
表1.利用SPR分析丙氨酸突變對hCEACAM5與tusa Fab+Fc結合的影響
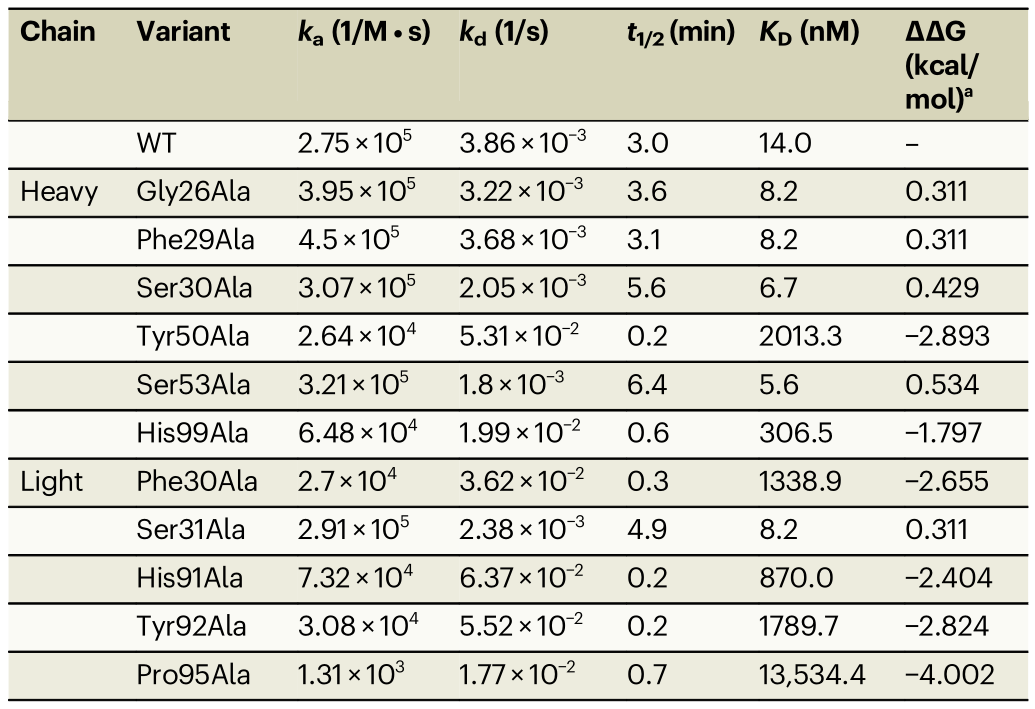
注:ka:結合常數,kd:解離常數,KD:結合常數,t1/2:解離半衰期,WT:野生型。
a.野生型tusa Fab和丙氨酸變體之間結合自由能變化(構象穩定性)的差異(ΔGWT -ΔGAla)。負值表明丙氨酸突變在能量上是不利的(即,需要比WT蛋白更多的能量來折疊)。
2.2.3HDX-MS分析
游離CEACAM5和CEACAM5-tusa Fab復合物氘攝取的差異表明CEACAM5表位涉及殘基607-613和629-641。游離tusa Fab和CEACAM5-tusa Fab復合物氘攝取的差異表明tusa Fab結合表位涉及重鏈中的101-109殘基和輕鏈中的48-54和88-104殘基。
2.2.4小結
通過多種方法(cryo-EM,SPR和HDX-MS)鑒定出tusa Fab 表位中16個氨基酸殘基(10個在重鏈上,6個在輕鏈上)(圖3a)。當發生丙氨酸突變時,6個殘基(重鏈:Tyr32、Asp33、Tyr100和Phe101;輕鏈:Tyr32和Asn50)與hCEACAM5A3-B3結合能力喪失,2個殘基(輕鏈:Phe30和Tyr92)的結合能力變弱。
通過丙氨酸誘變鑒定的Tusa Fab表面殘基大多與cryo-EM鑒定的殘基一致(圖3b)。綜合來看,當聚集在低溫電鏡核心區域的殘基突變為丙氨酸時,會導致與hCEACAM5結合能力喪失,而當距離更遠的殘基突變為丙氨酸時,會導致結合變弱。HDX法鑒定的hCEACAM5表位比低溫電鏡法鑒定的表位表面積小;然而,這兩種方法檢測到的相互作用核心區域都在B3結構域(圖3c)。

圖3.hCEACAM5A3-B3與tusa Fab結合界面的不同分析技術鑒定結果
注:Ala-Scan,丙氨酸掃描誘變;Ala+SPR,丙氨酸變體的表面等離子體共振;cryo-EM,低溫電子顯微鏡;HC,重鏈;hCEACAM5,人癌胚抗原相關細胞粘附分子5;hCEACAM5A3-B3,人癌胚抗原相關細胞粘附分子5的A3-B3結構域;HDX,氫-氘交換;LC,輕鏈;MAN,甘露糖;tusa Fab,tusamitamab抗原結合片段。
a.hCEACAM5A3-B3與tusa Fab復合物中相互作用殘基的比較。氫鍵用虛線表示。b.通過丙氨酸誘變鑒定的tusa Fab表位殘基(黃色高亮表示部分結合,紅色高亮表示沒有結合)和冷凍電鏡(淺粉色高亮表示重鏈的相互作用殘基,洋紅色高亮表示輕鏈的相互作用殘基)的比較,tusa Fab重鏈和輕鏈的溶劑可溶表面分別用淺棕色和淺藍色表示。c.HDX(紅色)和cryo-EM(洋紅色)鑒定的hCEACAM5表位殘基比較。hCEACAM5A3-B3和N-鏈聚糖的溶劑可溶表面分別為金棕色和淺棕色。b,c二級結構(較深的帶狀結構和球棍結構)。
2.3討論
CEACAM蛋白家族中,CEACAM5獨特表位的確定對理解其特異性結合至關重要,特別是A3-B3結構域的表位,對抗體-藥物偶聯機制具有重要意義。本研究通過cryo-EM、HDX-MS和SPR鑒定獲得的CEACAM5A3-B3與tusamitamab(tusa Fab)結合表位基本一致。其中tusa Fab結合表位中的16個氨基酸殘基與抗體特異性、親和力有關。這些殘基多屬于芳香殘基(Tyr、Trp和Phe)、短親水側鏈殘基(Ser、Thr、Asp和Asn)或甘氨酸。這些殘基聚集在重鏈上(特別是CDR3),通過氫鍵或范德華力穩定結合界面。16個殘基中有6個突變為丙氨酸時,與hCEACAM5A3-B3結合能力喪失,2個突變后結合能力變弱。
hCEACAM5表位涉及A3和B3結構域;Tusa Fab主要結合B3結構域,與A3作用較少。hCEACAM5 B3結構域主要涉及6個殘基(Ser622、Gln624、Gln635、His636、Thr637和Val639),特別是Gln624能同時與重鏈和輕鏈形成氫鍵。4個氫鍵殘基(Gln635、His636、Thr637和Val639)和1個疏水殘基(Phe641),可能對hCEACAM5表位至關重要。
此外,在B3結構域Asn612殘基上的N-連接甘露糖與tusa Fab重鏈形成氫鍵。N-糖基化傾向于降低蛋白質的靈活性,增加蛋白質的整體穩定性。因此,hCEACAM5A3-B3中的所有N-連接聚糖,包括與Asn612連接的聚糖,可能在形成被tusa Fab和其他參與hCEACAM5細胞功能的蛋白質識別的整體構象中發揮重要作用。聚糖在CEACAM5中的作用很重要,因為在hCEACAM5-tusa Fab結合界面中沒有鹽橋。鹽橋通過施加限制構象靈活性約束在抗體-抗原相互作用中發揮重要作用。Asn612殘基上的N-連接甘露糖可能具有補償和穩定功能,類似于沒有鹽橋的蛋白質復合物中的關鍵錨定殘基;這將增加結合界面的剛性,從而提高tusa Fab對hCEACAM5A3-B3的特異性。
研究人員推斷,tusa Fab對hCEACAM5的A3-B3結構域的特異性是由于tusa Fab重鏈和輕鏈與hCEACAM5A3-B3之間存在多種類型的相互作用,以及結合界面的構象約束(形狀互補)。這種結合機制可能使tusamitamab能夠將hCEACAM5與其他人類CEACAM(即CEACAM1、6和8)區分開,并將hCEACAM5中的A3-B3結構域與A1-B1和A2-B2結構域區分開。
參考文獻
Kumar A, Duffieux F, Gagnaire M, et al. Structural insights into epitope-paratope interactions of a monoclonal antibody targeting CEACAM5-expressing tumors[J]. Nat Commun, 2024, 15(1):9377.

相關產品



 蘇公網安備32011202001302
蘇公網安備32011202001302